- 비만은 당뇨병, 죽상동맥경화증, 대사증후군(MS), 수면 무호흡증과 같은 동반 질환을 동반하는 경향이 있는 것으로 알려져 있습니다[1–3]. 30세 이상 성인의 비만 유병률은 전 세계적으로 30%에 달하며, 이러한 높은 비만율은 식습관의 급격한 변화와 좌식 생활 방식으로 인해 특히 아시아인에서 두드러집니다[4].
- 복부 비만은 당뇨병 및 심혈관 질환(CVD)의 주요 위험 요인으로 알려져 있습니다[5]. 이러한 대사 질환의 위험 증가는 인슐린 저항성으로 인해 발생하며, 내장 지방은 피하 지방 축적과 다르게 유발됩니다. 복부 비만의 존재는 이소성 지방 침윤이 사람의 몸에서 시작되었음을 나타내며, 이는 복부에만 국한되지 않습니다. 이소성 지방 축적은 인슐린 저항성에 의해 발생하는 것으로 알려져 있습니다. 좀 더 구체적으로 말하자면, 우리 몸은 지방 조직에서 트리글리세라이드로서 과잉 에너지의 저장을 촉진하는 인슐린의 역할에 저항하며, 따라서 과도한 지방은 간, 근육, 복부 및 혈관 주위 영역과 같은 지방 조직 이외의 장소에 축적됩니다[6,7]. 이렇게 외부로 축적된 지방 침전물은 장기 기능을 방해하여 표적 장기에 인슐린 저항성을 유발합니다. 결과적으로 인슐린 저항성은 비알코올성 지방간 질환(NAFLD), 다발성경화증 및 제2형 당뇨병과 같은 대사 질환을 유발합니다.
- 강북삼성건강연구(KSHS)는 현재 한국에서 진행 중인 최대 규모의 건강검진 코호트 중 하나로, 전향적 및 후향적 연구를 지원하며, 매년 150,000명 이상의 피험자를 검진합니다. 저자는 성균관대학교 의과대학 강북삼성병원에서 임상의이자 연구원으로 근무하면서 KSHS 데이터셋에 대한 모든 권한을 가질 수 있는 기회를 가졌다.
- 국민건강보험공단은 국민건강보험공단 국민건강보험제도는 국민건강보험공단의 97.1%가 가입하고 있는 의무의료보험제도이다[8]. 우리나라에서 국민건강보험공단은 정부가 관리하는 단일 보험사입니다. 국민건강보험공단은 자격요건 데이터베이스, 의료보험금 청구 데이터베이스(의료서비스 제공자가 의료비로 청구한 의료비 청구서 기반), 건강검진 데이터베이스(일반 건강검진 결과 및 생활습관 및 행동에 대한 설문지 포함), 의료기관 데이터베이스(의료기관의 종류, 위치, 장비, 의사 수) 등을 포함하고 있다. 그리고 사망 기록부.
- 본 연구는 비만과 대사건강이 혈관건강에미치는 영향에 대한 임상적 시사점을 최신 지식을 바탕으로 논의하며, 주로 저자 자신의 연구에서 도출된 KSHS 및 NHIS 데이터 분석 결과에 초점을 맞춘다.
소개
- 최근 수십 년 동안 당뇨병, 고혈압, 비만, 이상지질혈증 등 CVD 위험인자의 유병률이 한국인에서 꾸준히 증가하고 있습니다. 2018년 국민건강보험공단 자료를 바탕으로 대한비만학회가 2020년 발표한 비만팩트시트에 따르면 우리나라 비만 유병률은 32.5%였다[4]. 2020년 대한당뇨병학회(KDA)가 발표한 당뇨병 팩트시트(Diabetes Fact Sheet)에 따르면, 2018년 국민건강영양조사[9]를 기준으로 30세 이상 한국인의 당뇨병 유병률은 13.8%로 나타났다. 또한 대한고혈압학회에서 발간한 고혈압 팩트시트(Hypertension Fact Sheet)에 따르면 2018년 대한민국 전체 인구 중 고혈압 유병률은 28.3%로 나타났다[10]. 마지막으로, 대한지질학회에서 발간한 이상지질혈증 팩트시트(Dydefidemia Fact Sheet)에 따르면 2018년 이상지질혈증 유병률은 40.5%였다[11]. 이 팩트 시트에 따르면 이러한 모든 위험 요인의 유병률은 지난 10년 동안 꾸준히 증가했습니다.
- 이러한 위험 요인의 유병률이 증가하고 있을 뿐만 아니라 발생률도 증가하고 있습니다. 질병관리청이 발표한 '한국의 당뇨병 및 합병증' 보고서에 따르면, 2006년부터 2015년까지 허혈성 심장질환, 뇌졸중, 심근경색 등 대혈관 합병증의 유병률은 모두 감소하는 경향을 보였다[12]. 그러나 한국인 당뇨병 환자에서 심부전(HF)과 말초동맥질환, 당뇨병성 망막병증, 당뇨병성 신증의 발병률이 증가하는 추세를 보였다. 당뇨병성 신증은 말기 신장 질환(ESRD)의 가장 흔한 원인이었으며, ESRD의 유병률도 증가했습니다.
- 결론적으로, CVD에 대한 위험 요인의 유병률은 이 분야의 의사와 의료 서비스 제공자의 노력에도 불구하고 지난 10년 동안 점진적으로 증가하고 있습니다. 특히 불길한 추세는 ESRD 및 시력 상실과 같은 미세혈관 합병증의 증가입니다.
한국의 비만과 당뇨병 유병률 추이와 그 결과
- 다발성경화증은 복부 비만, 고혈당, 고혈압, 이상지질혈증과 같은 대사 위험 요인의 군집으로 정의된다[13]. 다발성경화증의 정의에 대해서는 의견이 분분하지만, 현재 받아들여지고 있는 정의는 5가지 위험 요인 중 2개 이상의 존재이며, 이는 여러 연관성의 조화로운 합의에 의해 제시된 바와 같습니다[14]. 다발성경화증은 복부비만에 의해 발생하는 인슐린 저항성이 다양한 CVD 위험인자를 유발하여 당뇨병과 CVD를 유발하는 증후군입니다.
- 1988년 Reaven 교수가 다발성경화증의 존재를 "X 증후군"으로 제안한 후, 많은 협회에서 다발성경화증을 정의하려고 시도했습니다[15]. 아시아인에서 백인과 마찬가지로 다발성경화증의 정의에 동일한 허리둘레(WC) 컷오프를 적용하는 것에 관한 논쟁이 이어졌다. 우리 연구팀은 아시아인과 백인의 다발성경화증을 정의하기 위해 서로 다른 WC 컷오프를 적용해야 한다고 처음으로 주장했는데, 이는 이들 인종 집단에서 서로 다른 WC 및 체질량 지수 값을 적용했을 때 다발성경화증 유병률이 현저히 낮다는 결과를 근거로 한 것이다[16]. 우리의 제안에 따라 아시아인과 백인의 MS 정의에 대해 다른 WC 컷오프가 권장되었습니다.
- 다발성경화증 정의의 구성 요소, 특히 당뇨병과 고혈압을 다발성경화증의 구성 요소로 간주해야 하는지 여부에 대한 논쟁이 있었습니다[17,18]. 연구팀은 다발성경화증의 정의에 당뇨병이나 고혈압 환자가 포함되는지 제외되는지에 따라 발생하는 차이를 분석했다[19]. 2002년부터 2009년까지 CVD 병력이 없는 한국인 참가자 159,971명을 대상으로 추적관찰 기간 중앙값 3.7년을 대상으로 같은 기간 내 사망률을 평가했다. 다발성경화증 환자는 그렇지 않은 사람보다 모든 원인으로 인한 사망 및 CVD 사망률이 더 높은 것으로 관찰되었다. 그러나 이러한 위험 증가는 당뇨병이나 고혈압 환자를 제외한 후 약화되었으며, 이는 이러한 대사 질환을 포함하는 것이 다발성경화증으로 인한 CVD 사망률 증가를 설명한다는 것을 시사하여 당시 사용된 다발성경화증의 정의에 도전합니다.
- 2010년대 초반에는 다발성경화증과는 약간 다른 개념인 "대사적으로 건강한 비만"(MHO)이라는 개념이 도입되었습니다[20]. MHO는 일종의 "건강한" 비만이 있다는 개념을 말합니다. MHO 환자는 비만이지만 대사 건강하지 않은(MUH) 비만인 사람보다 복부 비만, 근육량 증가, 미토콘드리아 기능 수준 향상, 대사 유연성 향상을 보입니다.
- 우리 그룹은 무증상 죽상동맥경화증 표지자인 관상동맥 칼슘 점수(CACS)를 사용하여 MHO 환자의 심혈관 상태를 분석하기 위한 연구를 설계했습니다. CACS는 전체 관상동맥 죽상동맥경화성 질환 부담과 밀접한 관련이 있기 때문에 환자의 관상동맥 심장질환(CHD) 위험의 전반적인 지표로 알려져 있습니다[21]. 다민족 죽상동맥경화증(MESA) 연구와 같은 많은 코호트 연구는 기준선 CACS가 미래의 CHD 사건을 매우 잘 예측한다는 것을 보여주었으며, 이는 CACS가 CHD 위험에 대한 예측 마커 역할을 할 수 있음을 시사합니다[22,23].
- KSHS 참가자 24,063명을 대상으로 대사 건강과 CACS의 연관성을 분석한 결과, 비만과 관계없이 대사가 건강한 사람보다 MUH 환자에서 CACS가 유의하게 높은 것으로 나타났으며, 이는 MHO의 존재를 시사한다[24]. MHO 환자의 당뇨병 발병 위험을 분석한 결과, MHO 환자는 MUH 비만인보다 당뇨병 위험이 낮았다[25]. 두 연구 모두 MHO가 뚜렷한 표현형으로 존재한다는 것을 입증했지만, 많은 후속 연구에서는 MHO의 정의에 크게 의존한다고 주장하면서 MHO의 존재에 대해 논쟁을 벌였습니다[26].
대사 증후군, 대사 건강한 비만, 심혈관 위험
- 고혈당증은 최종 당화 산물의 수준 증가와 산화 스트레스 증가를 통해 죽상동맥경화증 및 사망률의 위험을 증가시키는 것으로 알려져 있습니다[27]. 2005년에서 2012년 사이에 241,299명의 KSHS 참가자를 대상으로 모든 원인, CVD 및 암으로 인한 사망 위험은 기준 혈당 상태(정상 혈당, 당뇨병 전증 및 당뇨병)와 당화혈색소(HbA1c) 수치를 기준으로 계산되었습니다[28]. 모든 원인으로 인한 사망률과 암 사망률의 위험은 정상 혈당증 환자보다 기준선 당뇨병 환자에서 유의하게 높았다. 항당뇨병 약물을 복용하지 않는 피험자에서 HbA1c 수치가 높거나 낮으면 모든 원인으로 인한 사망 위험이 높아졌습니다.
- 당뇨병이나 고혈당증이 있으면 관상동맥 석회화(CAC) 발병 위험이 높아집니다. 기준선에서 CACS가 0인 당뇨병이 없는 2,076명의 피험자를 대상으로 기준선 혈당 상태에 따라 CAC 발병 위험을 평가했습니다[29]. 4년 동안 당뇨병을 앓은 피험자는 세 그룹 중 CAC가 발생한 피험자의 비율이 가장 높았습니다. 인슐린 저항성은 정상에서 손상된 공복 혈당으로 진행된 피험자와 당뇨병이 발생한 피험자 모두에서 CAC 발생 위험이 유의하게 증가하는 것과 관련이 있었습니다. 그러나 기준선에서 인슐린 저항성이 없는 피험자는 당뇨병이 발병한 사람에서도 CAC 발생 위험이 유의하게 증가하지 않았으며, 이는 당뇨병 발병과 관련된 CAC 발생 위험 증가가 기준선에서 인슐린 저항성이 있는 피험자에서만 뚜렷하다는 것을 시사합니다.
- 이 연구의 결과에서 우리는 고혈당증과 인슐린 저항성이 CACS에서 평가한 무증상 죽상동맥경화증의 발병 및 진행과 유의미한 연관성을 보였다는 결론을 내릴 수 있었습니다.
인슐린 저항성, 고혈당증 및 무증상 죽상동맥경화증
- 지방 조직은 단순히 지방이 축적되는 것이 아닙니다. 대신 트리글리세라이드의 형태로 과잉 에너지를 저장하고, 아디포사이토카인을 분비하며, 다른 조직과 혼선을 하는 기관입니다[30]. 인슐린은 과도한 에너지를 다른 장기가 아닌 지방 조직에 저장하도록 하는 호르몬입니다. 그러나 인슐린 저항성이 있는 사람의 경우 과도한 에너지가 간, 복부, 근육 및 혈관 주위 영역과 같은 다른 조직에 저장될 수 있습니다. 이 현상을 이소성 지방 축적이라고 합니다. NAFLD는 음주 병력 없이 간에 지방이 축적되는 것을 특징으로 하는 질병입니다[31]. 간은 이소성 지방 축적이 일어나는 기관이기 때문에 NAFLD가 있는 사람은 이미 이소성 지방 축적이 이루어졌다는 것을 의미하며, 이는 인슐린 저항성이 발생했음을 나타냅니다.
- NAFLD와 당뇨병은 많은 역학 연구에서 알 수 있듯이 불가분의 관계에 있습니다[32]. 당뇨병 환자의 70-80%가 NAFLD를 가지고 있는 것으로 알려져 있으며, 당뇨병과 NAFLD 환자에서 당뇨병 합병증이 더 심합니다. 또한 NAFLD 환자는 당뇨병이 있는 경우 비알코올성 지방간염 및 섬유증에 더 취약하다는 것이 확인되었습니다. 따라서 두 질병을 예방하고 통제하는 것이 CVD 예방의 핵심 요소입니다.
- 또 다른 연구에서는 내장-피하 복부 지방 비율(VSR)과 NAFLD 및 간 섬유증의 연관성을 분석했습니다[33]. 7,456명의 KSHS 수험자에서 섬유증의 존재는 섬유증-4 점수(FIB-4)로 정의되었으며, 높은 VSR은 FIB-4 점수로 평가된 NAFLD 위험과 진행성 섬유증을 예측했습니다.
- 또한 인슐린 농도와 NAFLD 위험 사이의 연관성을 후향적으로 분석했습니다[34]. 4,956명의 KSHS 피험자에서 기준선 인슐린 농도가 높을수록 5년 후 NAFLD 발병 위험이 높아지는 것으로 나타났으며, 이는 고인슐린혈증이 NAFLD 발병에 영향을 미친다는 것을 시사합니다. 어쩌면 놀랍지 않게도, 이렇게 많은 수의 피험자에서 인슐린 수치를 측정한 연구는 거의 없습니다. 8년간의 추적 관찰을 통해 32,060명의 KSHS 참가자를 대상으로 인슐린 저항성의 기준선 항상성 모델 평가(HOMA-IR)와 NAFLD 간의 연관성을 분석한 또 다른 연구에서는 HOMA-IR 값으로 평가한 기준선 인슐린 저항성 정도가 당뇨병이 없는 NAFLD 환자의 향후 섬유증 진행과 긍정적인 관련이 있음을 발견했습니다.
- 최근 연구의 증거에 따르면 NAFLD는 CVD 위험 요인입니다[35]. KSHS에 참여한 21,335명의 참가자를 대상으로 CAC의 위험도를 NAFLD가 있거나 없는 사람과 체질량 지수로 평가한 비만 사이의 위험도를 비교했습니다. CAC의 위험은 두 가지 이상을 모두 가진 그룹에서 가장 높았으며, NAFLD 단독 그룹은 복부 비만 그룹보다 CAC 위험이 유의하게 높았으며, 이는 NAFLD의 존재가 비만의 존재와 관계없이 무증상 죽상동맥경화증의 위험을 증가시킬 수 있음을 시사합니다. 1,575명의 KSHS 참가자를 대상으로 수행된 또 다른 연구에서는 NAFLD와 고감도 C-반응성 단백질(hs-CRP) 수치가 모두 있는 피험자≥0.06mg/dL)에서 CAC 발생 위험이 가장 높았으며, NAFLD만 있는 피험자, hs-CRP만 ≥0.06mg/dL, NAFLD와 hs-CRP가 없는 피험자<0.06mg/dL)가 그 뒤를 이었으며, 이는 NAFLD와 전신 염증이 동시에 존재함을 시사합니다. HS-CRP에 의해 평가된 바와 같이, CAC 발생의 위험을 증가시킵니다.
- NAFLD는 내분비학 및 대사 분야에서 가장 주목받는 연구 분야 중 하나로, 최근 당뇨병, 다발성경화증 등 비만과 관련된 대사성 질환의 유병률이 증가함에 따라 상당한 관심을 받고 있습니다. NAFLD와 다른 대사 질환의 관계를 밝히기 위한 추가 연구가 필요합니다.
비알코올성 지방간 질환과 당뇨병 및 심혈관 질환 위험과의 연관성
- 최근에는 CVD 위험 요인의 가변성과 실제 CVD 또는 당뇨병의 위험 사이의 관계에 대한 관심이 높아지고 있습니다[36]. CVD 위험 요인의 가변성과 CVD 또는 당뇨병 위험 증가 사이의 연관성에 대한 세부 사항은 개별 위험 요인에 따라 다릅니다. 그러나 일반적인 메커니즘은 위험 요인의 불안정성으로 인한 산화 스트레스 및 염증 증가일 수 있습니다.
- 당뇨병이 없는 국민건강검진 참가자 2,827,950명을 대상으로 총콜레스테롤(TC) 수치의 변동성과 제2형 당뇨병 발병 위험의 관계를 분석했다[37]. 당뇨병 발병 위험이 가장 높은 콜레스테롤 변이는 가장 낮은 십분위수와 비교하여 가장 높은 분위수에서 발견되었습니다. 항고지혈증 약물 사용 및 기준선 TC 수치에 관계없이 일관된 결과를 얻었으며, 이는 TC 수치의 변화가 큰 참가자가 당뇨병 발병 위험이 더 높다는 것을 시사합니다.
- 또 다른 연구에서는 체중 변동성과 당뇨병 발병 위험 사이의 연관성을 분석했습니다[38]. 5년 연속 건강검진을 실시한 4,818명의 KSHS 수험생에서 높은 체중 변동성은 4년 동안 당뇨병 발병 위험 증가와 유의한 연관성이 있었으며, 이는 특히 과체중 또는 비만에서 뚜렷하게 나타났다.
- 헤모글로빈 당화 지수(HGI)는 측정된 HbA1c 수치에서 예측된 HbA1c 수치를 빼서 계산합니다. 예측된 HbA1c 수치는 혈당과 HbA1c 수치 사이의 선형 회귀 방정식을 사용하여 관찰된 평균 혈당 수치를 기준으로 계산됩니다. HGI가 높거나 낮은 개인은 혈당 수치에서 예상되는 것보다 높거나 낮은 HbA1c 수치를 가지고 있습니다. 이는 개별 서명으로 간주될 수 있습니다[39,40]. 4년 동안 당뇨병이 없는 참가자를 대상으로 CAC 발생과 HGI 변화 사이의 연관성을 분석했다[41]. 기준선 HGI가 높고 지속적으로 높은 HGI를 가진 참가자는 기준선 HGI가 낮은 참가자보다 CAC 발생 위험이 더 높았으며, 4년 동안 HGI가 증가하면 기준선 HbA1c 수치에 관계없이 CAC 위험이 유의하게 증가했습니다.
위험 요인 가변성 및 당뇨병 및 죽상동맥경화증 위험
- 최근 한국의 전국 연구에서는 많은 참가자의 혈당 상태, 비만 상태, 각종 질병 간의 연관성을 시사하고 있다. 2009년 국민건강검진을 받은 한국 성인 9,720,220명을 대상으로 HF의 위험도를 기준선 비만과 혈당 상태에 따라 평가하였다[42]. 비만은 HF의 위험과 반비례 J자형 상관관계를 보였으며, 저체중 및 2등급 이상의 비만에서 위험이 증가했다. 또한, 한국인을 대상으로 한 문헌 사상 최초로 당뇨병 전증 및 당뇨병 환자에서 HF 위험이 각각 8%와 86% 증가한 것으로 보고되었습니다.
- 또한, 2009년부터 2010년까지 국민건강검진을 받고 2016년까지 파킨슨병 평가를 위해 추적관찰한 한국인 8,443,353명을 대상으로 혈당 유무와 파킨슨병 위험의 연관성을 분석하였다[43]. 파킨슨병의 위험은 기준선 혈당 상태가 정상 혈당에서 당뇨병으로 악화됨에 따라 유의하게 증가했습니다.
- 이 두 질병 사이의 연관성을 뒷받침하는 정확한 메커니즘은 완전히 밝혀지지 않았지만 미토콘드리아 기능 장애, 소포체 스트레스, 만성 저등급 염증 및 신진대사 변화는 당뇨병뿐만 아니라 인슐린 저항성과 궁극적으로 신경퇴행성 장애를 유발하는 것으로 생각됩니다.
비만 정도, 혈당 상태 및 기타 질병 간의 연관성
- 비만, 고혈당, 고혈압, 이상지질혈증 등 다발성경화증과 관련된 위험인자의 유병률이 급격히 증가하고 있으며, 이러한 위험인자의 가변성은 CVD 및 당뇨병의 바람직하지 않은 결과와 관련이 있는 것으로 알려져 있습니다. 간의 지방 침윤에 의해서만 발생하는 것으로 생각되었던 NAFLD는 당뇨병의 원인으로 잘 알려져 있을 뿐만 아니라 당뇨병의 결과이기도 합니다(반대의 경우도 마찬가지). 최근 연구자들은 NAFLD가 CVD의 중요한 위험 요인이라는 점에 주목하고 있습니다. 또한 MHO는 비만이 CVD 위험을 증가시키지 않을 수 있는 알려지지 않은 메커니즘으로 인해 뜨거운 연구 분야였지만 최근 발표된 연구에서는 MHO의 존재에 대해 논쟁을 벌이고 정의에 크게 의존한다고 주장했습니다. 마지막으로, 전 세계적으로 비만과 당뇨병을 앓고 있는 인구가 급격히 증가함에 따라, 비만과 당뇨병은 HF와 파킨슨병과 같이 이전에는 관련이 없다고 생각했던 질병과 관련이 있는 것으로 보고되었습니다.
- 본 리뷰의 내용은 주로 저자 자신의 연구 결과에서 도출되었기 때문에 아직 풀어야 할 퍼즐 중 일부를 다루지 않았을 수 있습니다. 그러나 이러한 결과를 통해 비만의 표현형은 축적된 지방의 저장소, 해당 근육량 및 이소성 지방 축적의 존재 여부에 따라 완전히 다를 수 있다는 결론을 내릴 수 있습니다. 또한 NAFLD는 내분비학자와 간장학자 모두의 관심 분야이며 협업을 통해 우수한 결과를 얻을 수 있는 분야입니다. NAFLD는 CVD의 위험 요인으로 간주되기 때문에 이 분야의 추가 연구는 비만과 당뇨병 환자의 CVD를 예방할 수 있습니다. 이 분야의 연구에서 얻은 가장 중요한 교훈은 비만 치료에 있어 환자가 비만과 관련된 동반 질환 없이 가능한 한 오래 살 수 있도록 체중 감량뿐만 아니라 건강한 방법으로 체중 감량에 초점을 맞추는 것이 중요하다는 것입니다.
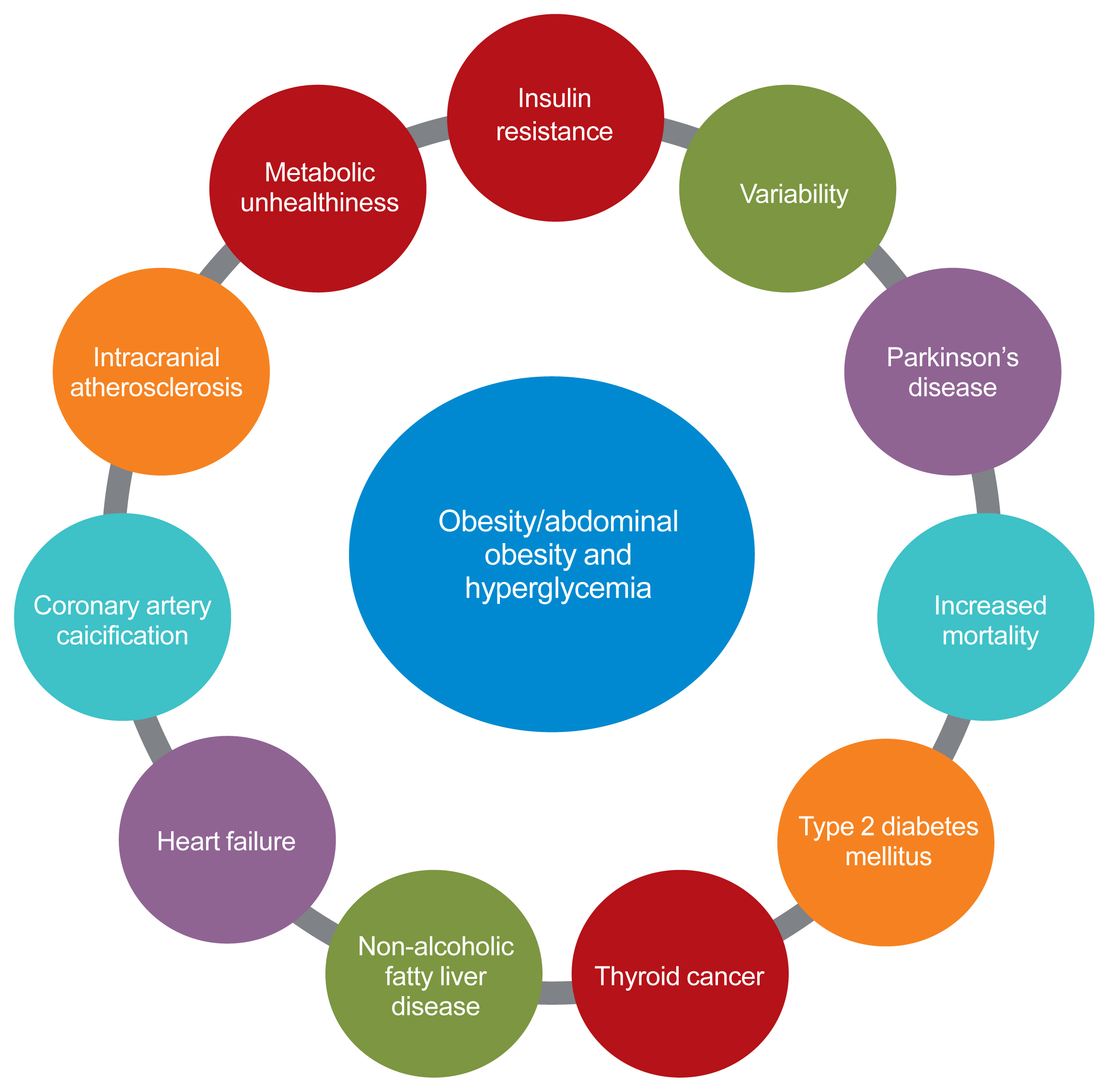
- 결론적으로, 저자 자신의 연구 결과에 따르면 비만(특히 복부 비만)과 그 변동성은 이소성 지방 축적 및 인슐린 저항성과 관련된 다양한 대사 질환과 밀접한 관련이 있습니다. 또한 복부 비만으로 인해 발생할 수 있는 고혈당증과 인슐린 저항성은 제2형 당뇨병 및 파킨슨병, HF와 같은 기타 예상치 못한 질병과 관련이 있습니다. 마지막으로, 대사 위험 인자 간의 이러한 관계는 모두 혈관 건강에 영향을 미칠 수 있으며, 결국 CVD의 위험을 증가시킬 수 있습니다(그림 1).
- 비만과 대사 질환 및 혈관 건강과의 연관성. Figure 다운로드
결론
- 승인
- 나 이은정은 제게 영예로운 남곡상을 주신 명예교수님 훈기민(남곡)님께 진심으로 감사드리며, 평안히 쉬시길 기원합니다. 연구자로서, 임상의로서 저의 커리어를 아낌없이 지원해주신 김선우 교수님, 이원영 교수님, 강성구 교수님, 강무일 교수님, 백기현 교수님, 오기원 교수님께 감사드립니다. 또한 우리 부서의 동료들과 우리 부서에서 교육을 받은 우수한 동료들의 지원에 감사드립니다. 끝으로 김경 교수님과 EnM에 대한 열정과 사랑 부탁드립니다.
남곡상은 대한내분비학회가 수여하는 최고 과학상으로, 내분비학 및 대사 분야의 발전에 탁월한 공헌을 한 개인에게 수여됩니다. 남곡상은 1982년 대한내분비학회를 창설한 훈기민 교수의 필명에서 따왔다. 이은정 교수는 2021년 10월 대한내분비학회 제9회 서울국제내분비대사학회에서 남곡상을 수상했다.
이해관계의 상충
이 기사와 관련된 잠재적인 이해 상충은 보고되지 않았습니다.
Copyright © 2022 대한내분비학회
이 글은 크리에이티브 커먼즈 저작자 표시 비상업적 라이선스(https://creativecommons.org/licenses/by-nc/4.0/)의 조건에 따라 배포되는 오픈 액세스 기사로, 원본 저작물이 적절하게 인용된 경우 모든 매체에서 무제한 비상업적 사용, 배포 및 복제를 허용합니다.
기사 정보
- 1. 세계보건기구(WHO). 과체중과 비만 [인터넷] 제네바: WHO; 2021 [2022년 1월 25일 인용]. 다음에서 사용 가능: https://www.who.int/news-room/fact-sheets/detail/obesity-and-overweight .
- 2. Jarolimova J, Tagoni J, 스턴 TA. 비만: 역학, 동반 질환 및 관리. 프림 케어 컴패니언 CNS Disord 2013 15:PCC.12f01475.
- 3. Gallagher EJ, LeRoith D. 비만과 당뇨병: 암 및 암 관련 사망률의 위험 증가. Physiol 개정판 2015; 95:727–48.
- 4. 남GE, 김YH, 한K, 정정, 이이, 이와이 외 Obesity fact sheet, 2020: prevalence of obesity class from 2009 to 2018 (한국의 비만 팩트 시트, 2020: 2009년부터 2018년까지 비만 등급별 비만 유병률). J Obes Metab 신드르 2021; 30:141–8.
- 5. Bhupathiraju SN, Hu FB. 비만과 당뇨병 및 심혈관 합병증의 역학. Circ Res 2016년; 118:1723–35.
- 6. Lim S. 심장 대사 및 신장 위험에 초점을 맞춘 이소성 지방 평가. Endocrinol Metab (서울) 2014; 29:1–4.
- 7. 베이 HE. "아픈 지방", 대사 질환 및 죽상 동맥 경화증". Am J Med 2009년; 122(1 지원):S26–37.
- 8. 리 YH, 한 K, 코 SH, 코 KS, 리 쿠; 대한당뇨병협회 당뇨병 팩트 시트 태스크포스 팀. 국민건강보험공단이 구축한 국민건강정보 데이터베이스를 활용한 전국 인구기반 연구의 데이터 분석 과정. 당뇨병 Metab J 2016; 40:79–82.
- 9. Jung CH, Son JW, Kang S, Kim WJ, Kim HS, Kim HS, et al. 2020년 한국의 당뇨병 팩트 시트: 현재 상태 평가. 당뇨병 Metab J 2021; 45:1–10.
- 10. 김HC, 조SMJ, 이H, 이HH, 백J, 허 JE 외 한국 고혈압 팩트 시트 2020: 전국 인구 기반 데이터 분석. Clin Hypertens 2021;27:8입니다.
- 11. 이승만 팩트 시트에 근거한 한국 성인의 심혈관 위험 요인의 유병률과 현재 관리. Endocrinol Metab (서울) 2020; 35:85–94.
- 12. 대한당뇨병학회. 한국의 당뇨병 팩트 시트 [인터넷] 서울: KDA; 2019 [2022년 1월 25일 인용]. 다음에서 사용 가능: https://www.diabetes.or.kr/pro/news/admin.php?category=A&code=admin&mode=view&number=1788 .